Основы явления пассивности металлов
Пассивность — это состояние, которое возникает при торможении анодной реакции ионов металла в определенном диапазоне потенциалов. Переход металла из активного состояния в пассивное называется пассивацией, а обратное явление — активацией или депассивацией. С термодинамической точки зрения, пассивный металл не более благородный, чем активный. Однако, замедление коррозионных процессов происходит благодаря образованию фазовых и адсорбционных пленок на поверхности металла, которые и тормозят анодный процесс. Не всякое торможение коррозии может быть связано с явлением пассивации. Например, золото, платину и другие металлы, которые обладают термодинамической стабильностью, не называют пассивными (рисунок 1).
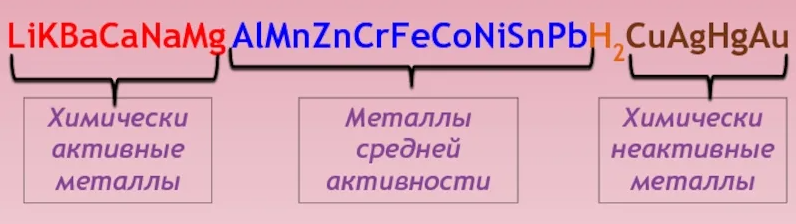
Рисунок 1 – Ряд активности металлов
Возникновение пассивности зависит от свойств металла, агрессивной среды (раствора электролита), температуры, концентрации раствора, движения раствора и ряда других факторов.
Существует две основных теории пассивности металлов: пленочная теория и адсорбционная теория. Согласно пленочной теории, торможение коррозийного процесса наступает благодаря образованию на поверхности металла тонкой пленки из кислородосодержащих веществ (рисунок 2).
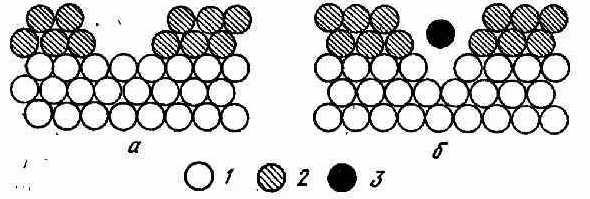
Рисунок 2 – Схематичное изображение пленочной теории пассивности металла 1 – атомы железа, 2 – молекулы окислов, 3 – ион металла
Адсорбционная теория (рисунок 3) объясняет пассивность образованием мономолекулярной пленки или заполнением только части поверхности металла кислородом или кислородосодержащими соединениями. Обе теории дополняют друг друга и позволяют объяснить различные случаи пассивности металлов.
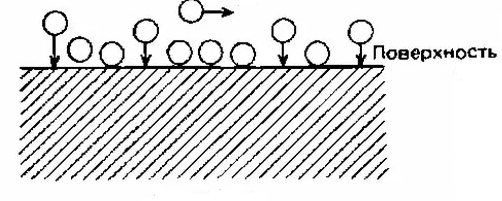
Рисунок 3 – Схематичное изображение адсорбционной теории пассивности металла
При повышении окислительной способности окружающей среды, многие металлы и сплавы могут стать более пассивными. Однако, при чрезмерном увеличении окислительно-восстановительного потенциала, запассивированные материалы могут потерять свою пассивность и перейти снова в активное состояние. Это явление называется перепассивацией или транспассивностью, что характерно, для некоторых металлов, например, хрома, для которого процесс коррозии может ускориться в сильно окислительных средах.
Термодинамическая устойчивость металла может быть оценена по величине стандартного электродного потенциала. Сдвиг в сторону положительных значений потенциала означает повышение устойчивости. Однако, теоретическая вероятность протекания коррозионного процесса не всегда соответствует реальной скорости коррозии. Например, алюминий имеет более отрицательный стандартный потенциал (минус 1,67В), чем железо (минус 0,44В), но алюминий более устойчив к коррозии с точки зрения термодинамики, поскольку на его поверхности всегда присутствует тончайшая естественная оксидная пленка.
Положение металла в Периодической системе также не определяет его коррозионную устойчивость, однако существуют определенные закономерности в поведении металлов под воздействием окружающей среды. Наиболее коррозионно неустойчивыми металлами являются металлы щелочных и щелочно-земельных групп, такие как Na, K, Ca и Mg. Более устойчивыми являются металлы побочных подгрупп I и II, например Cu, Ag и Au, а также Zn, Cd и Hg. В подгруппах VI и VIII находятся металлы с высокой склонностью к пассивации, такие как Cr, Mo и W. Наибольшей коррозионной стойкостью обладают металлы группы VIII, такие как Os, Ir и Pt, а также золото.