Термодинамика и электрохимия явления пассивации
Явление пассивации с успехом используется в практике защиты металлов от коррозии, особенный интерес представляет пассивность металлов в высокоагрессивных электролитах (например, в сильных кислотах), в которых защищать металл особенно трудно.
Анодное поведение метала, склонного к пассивации в коррозионной среде за счет образования кислородных соединений метала, в общем случае, может быть описано полной поляризационной кривой, представленной на рисунке 1.
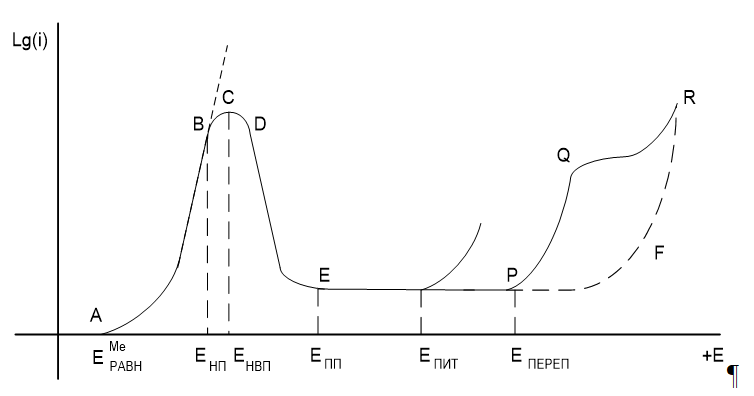
Рисунок 1 – Анодная поляризационная кривая пассивирующегося металла
На анодной поляризационной кривой можно выделить следующие участки:
Участок АВ – область активного растворения металла с образованием гидратированных катионов:
Me − ne + mH2O → [Me (H2Om)]+n
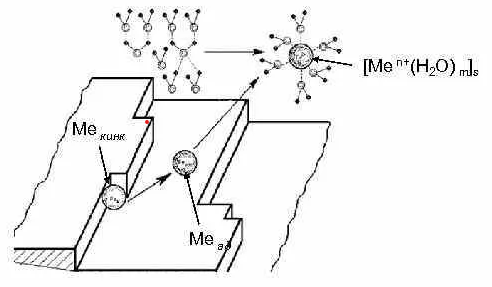
Рисунок 2 – Механизм активного растворения металла
При потенциалах положительнее потенциала начала пассивации (Енп) происходит образование кислородных соединений металла по реакциям:
mMe − 2ne + nH2O → Mem/On + 2nH+
mMe − 2ne + nH2O → MemOn + 2nH+
Me − ne + nH2O → Me(OН)n + nH+
Анодный процесс при этом тормозится, зависимость lg(i) – Е становится нелинейной. При потенциале положительнее Енвп (потенциал начала видимой пассивации) торможение анодного процесса за счет образования пассивирующих пленок становится большим, чем увеличение его за счет роста потенциала, значение анодного тока падает.
Участок ЕР – область пассивации. Растворение металла происходит с небольшой скоростью, при этом на металле протекают параллельно две реакции:
а) растворение гидроксидных и оксидных пленок под воздействием окружающей среды:
Me(OН)n + nH+ → Men++ nH2O
MemOn+ 2nH+ → Me++2n/m+ nH2O
б) возобновление гидроксидной и оксидной пленки за счет электрохимических реакций:
mMe − 2ne + nH2O →MemOn + 2nH+
Me − ne + nH2O → Me(OН)n + nH+
Скорость определяющей реакцией в этом случае является химическая реакция растворения оксида и гидроксида, в связи с чем в области пассивации скорость растворения металла не зависит от потенциала.
Потенциал Епп называют потенциалом пассивации, или Фладе–потенциалом.
При потенциалах положительнее потенциала Епереп (потенциал перепассивации) металл начинает растворяться с образованием сложных анионов металла:
Me + 2H2O − 2e → MeО2 –2 + 4H+
Me + 2H2O − 3e → MeО2 – + 4H+
В результате протекания этих реакций металл вновь активируется, на анодной кривой наблюдается увеличение тока.
Участок QR характеризует предельный ток, обусловленный замедленностью отвода образующихся анионов MeО2 2-, MeО2–
Очередное повышение величины тока на анодной кривой при потенциалах положительнее точки R связано с выделением кислорода по реакции:
2Н2О – 4e → О2+4Н+
Ход кривой с пассивацией во многом зависит от присутствия в электролите ионов Сl–. При их наличии область пассивации может уменьшиться и повышение тока начинается при потенциале Епит (потенциал питтингообразования). Металл в этом случае растворяется локально, на его поверхности появляется питтинг (рисунок 3).
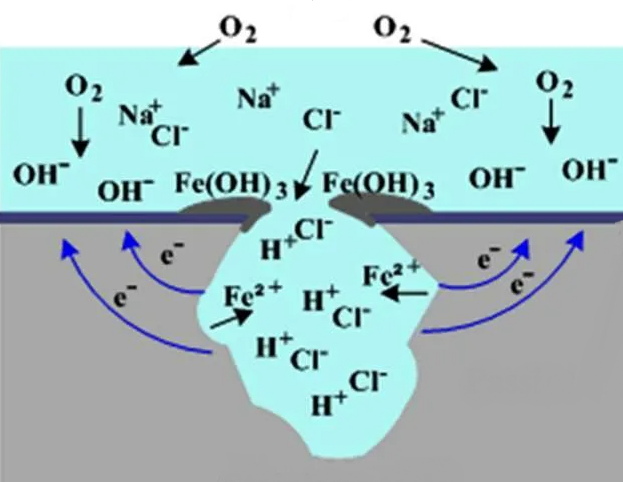
Рисунок 3 – Механизм появления питтинга в присутствии хлоридов
Влияние Сl– иона на пассивность объясняется тем, что хлор–ионы, являясь поверхностно–активными, вытесняют адсорбированный кислород в порах оксидных и гидроксидных пленок, после чего поверхность металла в этих местах активируется, начинается локальное растворение металла:
2Me/O + 2Cl– → 2Me/Cl– + O2
При большом количестве хлор–ионов в электролите пассивация может вообще исчезнуть.